Braunschweig. Wie das Helmholtz-Zentrum für Infektionsforschung (HZI) mitteilt, ist es in Kooperation mit dem Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS) gelungen, ein natürliches Antibiotikum mit dem Potenzial als Krebsmedikament zu finden.
Der Naturstoff Carolacton wird von im Boden lebenden Mikroorganismen gebildet und hat antibiotische Eigenschaften. Forscher an HZI und HIPS fanden jetzt heraus, dass der bakterielle Wirkstoff ein Schlüsselenzym des Folsäurestoffwechsels hemmt. Dieser Stoffwechselweg kommt in den meisten Lebewesen vor und ist essenziell für ihr Wachstum, da zum Beispiel DNA-Bausteine darüber hergestellt werden. Da dies auch für Menschen gilt, ist Carolacton als Antibiotikum kaum einsetzbar. Allerdings wird das Zielenzym von schnell wachsenden Krebszellen verstärkt benötigt und diese können durch Carolacton in ihrem Wachstum gebremst werden. Die neuen Erkenntnisse zeigen, dass Carolacton oder davon abgeleitete Wirkstoffe künftig als Hemmstoffe in der Krebstherapie zum Einsatz kommen könnten. Ihre Ergebnisse veröffentlichten die Forscher vor kurzem im Fachjournal Nature Communications.
Naturstoffe noch häufig unbekannt
Naturstoffe dienen seit Jahrtausenden als Quelle neuer Medikamente, doch obwohl sie oft schon lange erfolgreich eingesetzt werden, bleibt ihre genaue Wirkweise häufig unbekannt. Der Naturstoff Carolacton gehört zur Stoffklasse der Polyketide und wurde aus dem im Boden lebenden Myxobakterium Sorangium cellulosum isoliert. „Carolacton kann wichtige Prozesse in Bakterien stören und so auch die Biofilmbildung von Streptococcus mutans, dem Hauptverursacher von Zahnkaries, reduzieren“, sagt Prof. Rolf Müller, Leiter der Abteilung „Mikrobielle Naturstoffe“ und Geschäftsführender Direktor am HIPS. „Gleichzeitig ist Carolacton ein Wachstumsinhibitor von Streptococcus pneumonieae, einem der lebensbedrohlichsten Mikroorganismen.“
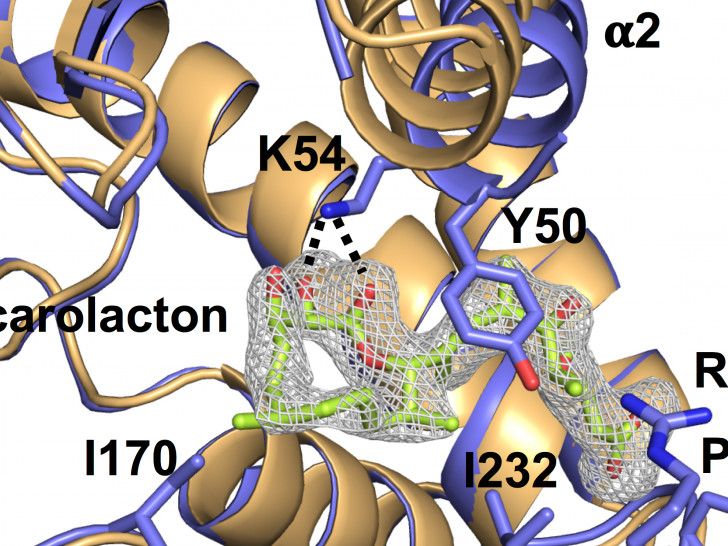
Neben antibiotischen Aktivitäten weckte vor allem die Antibiofilm-Aktivität von Carolacton das Interesse der Forscher. Ihr Ziel war es herauszufinden, wie diese Hemmung genau funktioniert und welcher Mechanismus sich dahinter verbirgt. Kürzlich gelang es den HIPS-Forschern in Zusammenarbeit mit Prof. Irene Wagner-Döbler vom HZI, in den Modellorganismen Escherichia coli und Streptococcus pneumoniae das molekulare Ziel – das sogenannte Target – des Wirkstoffs zu identifizieren: Carolacton kann das Schlüsselenzym FolD des C1-Stoffwechsels („C“ steht für Kohlenstoff) hochspezifisch binden und es dadurch ausschalten. FolD ist an der Bildung von Folsäure im C1-Stoffwechsel beteiligt. In Zusammenarbeit mit der Nachwuchsgruppe „Strukturbiologie biosynthetischer Enzyme“ von Dr. Jesko Köhnke wurden außerdem die Kristallstruktur und die Bindeeigenschaften von Carolacton an FolD detailliert aufgeklärt.
Erkenntnisse mit weitreichenden Konsequenzen
Die neuen Erkenntnisse der Forscher aus Saarbrücken und Braunschweig haben weitreichende Konsequenzen. „Der C1-Stoffwechsel zählt zu den wichtigsten Stoffkreisläufen und ist hochkonserviert durch alle Domänen des Lebens. Er stellt wichtige Bausteine des Wachstums bereit, wie etwa Nukleinsäuren, Aminosäuren und Provitamine“, sagt Irene Wagner-Döbler. „Wir finden deshalb konservierte Gene für das Schlüsselenzym FolD in vielen verschiedenen Spezies, so auch in den Mitochondrien menschlicher Zellen. Durch den hohen Grad der Konservierung zwischen dem bakteriellen FolD-Enzym und dem menschlichen Enzym in Mitochondrien, vor allem im Bereich der Carolacton-Bindestellen, hemmt der Naturstoff auch das Enzym der Mitochondrien. Damit ist der Einsatz von Carolacton als Antibiotikum beim Menschen kaum vorstellbar.“
Gleichzeitig hat sich aber eine neue Einsatzmöglichkeit für den Naturstoff eröffnet. „Das Schlüsselenzym wird in vielen Tumorzellen übermäßig produziert. Wir konnten in ersten Experimenten hemmende Effekte bei verschiedenen getesteten Krebszelllinien zeigen“, sagt Rolf Müller. „Carolacton wäre daher ein sehr guter Ausgangspunkt für den Einsatz als Inhibitor in der Krebstherapie. Zukünftig müssen aber die pharmazeutischen Eigenschaften des Moleküls optimiert werden.“
Die Forschungsarbeiten wurden vom Bundesministerium für Bildung und Forschung im Systembiologieprogramm ebio gefördert und auch im Rahmen des Deutschen Zentrums für Infektionsforschung (DZIF) durchgeführt.
mehr News aus Braunschweig